
por CenterLab | jul 11, 2021 | Informativos
Anticorpos Neutralizantes e Anti-RBD na Covid-19
A atual pandemia de COVID-19, declarada em 11 de março de 2020 pela Organização Mundial da Saúde, teve seus primeiros casos relatados em dezembro de 2019, em Wuhan, província de Hubei, na China. Trata-se de uma doença respiratória decorrente da infecção causada pelo novo coronavírus, posteriormente batizado de SARS-CoV-2. Os coronavírus são RNA vírus pertencentes à família Coronaviridae, formados por RNA de fita simples positiva, contendo um nucleocapsídeo e proteínas Spike (S) ou espículas – que conferem aparência de coroa solar (Corona em latim) – figura 1. Os vírus são estruturas obrigatoriamente intracelulares e possuem como principal característica a replicação viral dependente de uma célula metabolicamente ativa, para originar novas partículas virais.
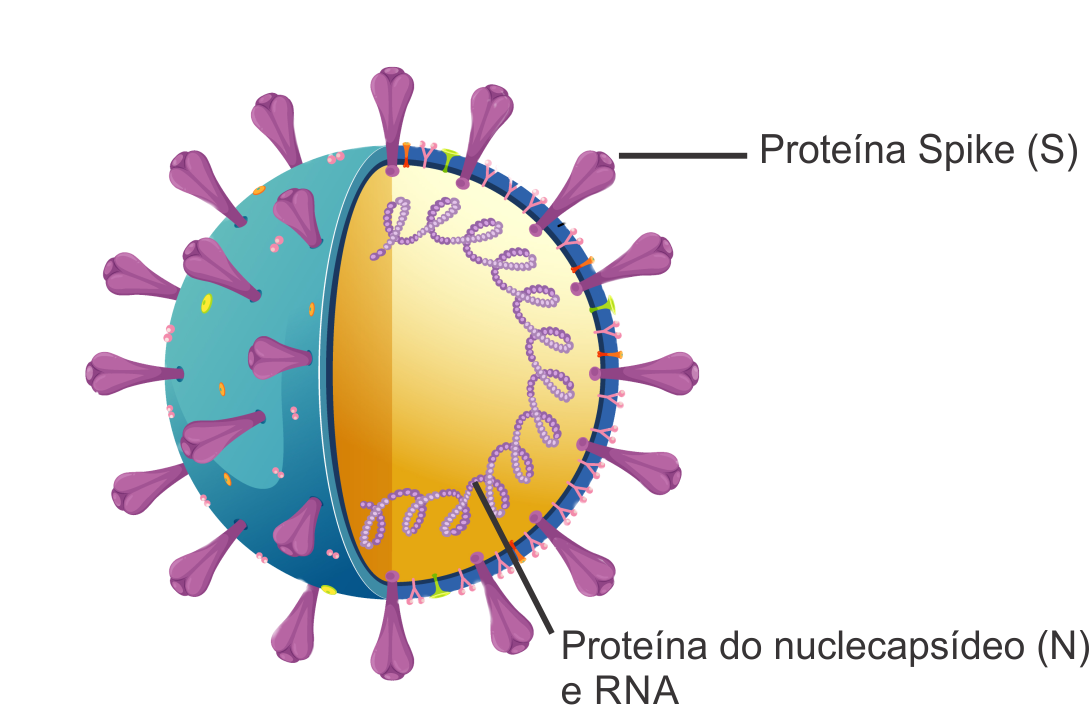
Logo, a ligação entre a glicoproteína Spike (S) e o receptor celular ECA2 (Enzima Conversora de Angiotensina) presente em células do trato respiratório e digestivo é responsável pelo tropismo do vírus SARS-CoV-2 pela célula hospedeira. Estruturalmente, a glicoproteína S divide-se em quatro diferentes regiões: domínio transmembranar; curto domínio citoplasmático; subunidade S1 (equivalente ao domínio N-terminal) – responsável pela ligação ao receptor celular ECA2 – e a subunidade S2 (equivalente ao domínio C-terminal) – envolvida no mecanismo de penetração viral. A parte que nos interessa está contida na subunidade S1, onde se localiza a região chamada domínio de ligação do receptor (RBD do inglês). Esta subunidade é o local para muitos anticorpos com função de neutralização impedindo o vírus de ligar-se ao receptor ACE2 da célula. Os anticorpos específicos que desenvolvemos quando entramos em contato com um vírus ou uma bactéria estão entre as principais moléculas produzidas pelo corpo para evitar as doenças. Nem todos têm a capacidade de bloquear a ação do vírus; os que conseguem fazer isso são chamados de neutralizantes.
Na busca por combater o vírus Sars-CoV-2, pesquisadores do mundo todo trabalham para desenvolver tratamentos que minimizem os efeitos da Covid-19 – a doença por ele causada – e vacinas que protejam contra a infecção. Segundo eles, vacinas que se mostraram mais eficazes geraram maior quantidade de anticorpos neutralizantes.
Alguns dados já publicados mostram que as chances de ser internado ou morrer com o Sars-CoV-2 caem drasticamente depois da imunização completa, que ocorre cerca de um mês depois da segunda injeção para as vacinas usadas no Brasil, aplicadas em duas doses.
Com o avanço da pandemia torna-se cada vez maior a demanda por exames para diagnóstico da população. Entretanto com a possibilidade de reinfecção e a introdução de vacinas aumentou o interesse por métodos que pudessem avaliar a imunidade do indivíduo. Para isso, existem no mercado diversas opções de testes de Covid-19. Entre eles, os testes com leitura exclusiva de anticorpos neutralizantes e anti-RBD. Os kits que utilizam a proteína S são uma alternativa viável para se avaliar a soroconversão, seja em pacientes com contato prévio/recuperados da doença em si, ou após o esquema de qualquer das vacinas atualmente disponíveis. Para uma melhor sensibilidade, recomendam-se a testagem de 14-21 dias do início dos sintomas ou da segunda dose da vacina. Contudo, os testes sorológicos específicos para identificação de anticorpos neutralizantes, possuem uma grande importância para avaliação da imunidade contra a covid- 19, entretanto devem ser interpretados com cautela sempre em conjunto com outras informações clínicas e exames complementares do paciente, juntamente com as particularidades dos testes. Além disso, pessoas vacinadas parcialmente ou com esquema de vacinação completo, ou que já tiveram infecção natural recente, não estão isentas das medidas protetivas preconizadas, como o uso de máscaras em espaços públicos, higienização das mãos e do distanciamento social.
A Centerlab, em parceria com a ECO e Celer, duas grandes empresas referências em diagnósticos rápidos, mantendo sempre o espírito inovador de grande qualidade e acessível a todos nossos clientes independente de seu porte, tem a grande satisfação de disponibilizar os Kits para teste, por método de imunofluorescência em Point Of Care, de anticorpos neutralizantes e anti-RBD como diagnósticos complementar na Covid-19. Simples e rápido.
Teste de Anticorpos 2019-nCoV
Imunoensaio fluorescente utilizado em conjunto com o Finecare para detecção rápida e qualitativa do anticorpo RBD do SARS-CoV-2, em amostras de sangue total, soro ou plasma humano.
Resultado em 15 minutos!
ECO F Teste de Covid nAb
Detecção de anticorpos neutralizantes
Teste ideal para verificar imunidade* de quem já teve contato com o vírus ou foi vacinado.
*Presença de anticorpos neutralizantes para SARS CoV 2 que indica possivelmente imunidade das vias aéreas inferiores.
Bibliografia:
-https://virologyj.biomedcentral.com/articles/10.1186/1743-422X-2-73 Xiao X, Chakraborti S, Dimitrov AS, Gramatikoff K, Dimitrov DS: A glicoproteína SARS-CoV S: expressão e caracterização funcional. Biochem Biophys Res Commun 2003, 312: 1159-1164. 10.1016 / j.bbrc.2003.11.054;
– https://www.nature.com/articles/s41586-020-2456-9;
– https://celer.ind.br/produto/finecare-plus/;
– https://ecodiagnostica.com.br/;
– https://www.folhape.com.br/noticias/anticorpos-neutralizantes-podem-indicar-imunidade-apos-vacina/184986/;
-https://www.gov.br/inpi/pt-br/servicos/patentes/tecnologias-para-covid-19/Arquivos%20Textos/estudo-11-de-vacina-inativada_obtec_25062021.pdf.

por CenterLab | fev 2, 2021 | Novidades
O teste para Anticorpos Neutralizantes da Sars-cov-2 tem como objetivo avaliar a imunidade adquirida após a vacinação ou infecção do novo Coronavírus.
A amostra a ser utilizada pode tanto ser plasma ou soro, onde é possível encontrar os anticorpos neutralizantes que bloqueiam a ligação do vírus nas células humanas.
Diferente dos testes Antígeno ou PCR, com esse teste é possível avaliar se o organismo entrou em contato alguma vez com o novo Coronavírus e se apresenta resposta imunológica.
O teste é realizado a partir da linha exclusiva de analisadores F100, F200 e F2400, e seu princípio se baseia na emissão de luz fluorescente que pode variar dependendo da quantidade de anticorpos neutralizantes presentes na amostra, resultando em positivo ou negativo para anticorpos neutralizantes.
O resultado do teste é dado em % da inibição neutralizante.
Ensaio Qualitativo
Inibição neutralizante 20%: Positivo e anticorpo neutralizante contra SARS-CoV-2 detectado
Inibição neutralizante <20%: Negativo e anticorpo neutralizante contra SARS-CoV-2 não detectado
Conheça mais essa novidade no link: Anticorpos Neutralizantes


por CenterLab | jun 1, 2020 | Informativos
Texto: Carlos Eduardo Gouvêa (Presidente executivo da CBDL e Aladdiv) e Letícia Fonseca (Representante da Aladdiv)
COLUNISTA: DR. CARLOS EDUARDO GOUVÊA – 04 DE MAIO DE 2020
Em plena pandemia do Coronavírus, a única certeza de que temos é de que nada será como antes… Neste sentido, vemos grandes mudanças e quebras de paradigmas, não apenas em relação aos nossos hábitos e costumes, mas principalmente em relação às tecnologias de dispositivos médicos utilizados no combate a esta pandemia: respiradores, EPIs e, claro, diagnóstico in vitro.
Aqui no Brasil, em um movimento muito bem recebido por toda a Sociedade, a Agência Nacional de Vigilância Sanitária (ANVISA), inovou ao criar a figura de um registro provisório (válido por 1 ano) para os kits de diagnóstico do SARS-CoV-2 (coronavírus), caso a empresa que estivesse submetendo tal pedido não tivesse a totalidade dos documentos que anteriormente seriam necessários. Neste sentido, a Resolução RDC 348/2020 possibilitou que mais de 50 processos fossem analisados e deferidos em cerca de 40 dias de sua existência – fato sem precedentes até então.
Além de utilizar o conceito de “reliance” principalmente na questão de certificações de boas práticas de fabricação emitidas pelas autoridades regulatórias reconhecidas como de alto rigor pela ANVISA, ela permitiu a possibilidade de se complementar tais dossiês com estudos feitos com dados da vida real, de tal forma que tais registro se tornassem válidos então para 10 anos.
Desta forma, várias tecnologias têm sido liberadas para uso no Brasil, com destaque para os testes rápidos (imunocromatoráficos) e PCR TR, além de várias outras que trarão grande velocidade para o mercado laboratorial, tais como ELISA, quimioluminescência, fluorescência, dentre outras, inclusive de POC (point of care).Tais testes podem ser divididos entre testes moleculares ou de antígenos, para a detecção do vírus ou suas proteínas, na fase inicial, ou então sorológicos, voltados principalmente para a detecção dos anticorpos.
A Organização Mundial de Saúde (OMS) e a Organização Pan Americana de Saúde (OPAS) , pelo menos até o momento, têm se manifestado contrárias à utilização de testes para detecção de antígenos /anticorpos para COVID-19. Tal posição está fundamentada em duas questões: 1. A possibilidade de reação cruzada com outros coronavírus que normalmente estão presentes na comunidade, dificultando a interpretação de resultados . 2. A dinâmica de resposta do organismo humano na produção de anticorpos ainda não ser bem conhecida. Alguns estudos mostram que apenas 40% dos pacientes desenvolvem anticorpos durante os 6 ou 7 primeiros dias após o início dos sintomas .
Diante disso, resultados negativos obtidos com o uso de testes sorológicos não seriam ferramentas adequadas para afastar a possibilidade de infecção nos primeiros dias da doença. Resultados positivos devem ser avaliados em conjunto com outros sintomas, uma vez que há a possibilidade de reação cruzada com outros coronavírus. A posição da OMS/OPAS nos leva a refletir sobre a função dos produtos para diagnóstico in vitro (IVD). Esses produtos incluem reagentes, instrumentos e sistemas para testar amostras coletadas do corpo e destinados ao uso em um amplo espectro de aplicações de cuidados de saúde, entre eles a detecção precoce de doenças e condições e a geração de informações médicas relacionadas ao risco que informam a ação clínica.
Os produtos IVD disponíveis no mercado detectam o material genético do vírus, por meio de técnicas de biologia molecular (Polimerase Chain Reaction – PCR), detectam a presença de antígenos ou a presença de anticorpos (testes sorológicos). Cada um desses métodos possui características próprias e limitações, sendo necessário utilizar “o teste certo, no paciente certo, no ambiente certo, na hora certa ”. Nesse sentido, com o objetivo de ampliar o acesso da população à testagem para COVID-19, vários países têm estabelecido diretrizes para o uso de testes para detecção de antígenos e para detecção de anticorpos.
A estratégia de testagem pode variar, não apenas entre países como dentro do país. Nos Estados Unidos, o Food and Drug Administration (FDA), por meio do procedimento denominado “Emergency Use Authorizations (EUA)” publicou o “Policy for Diagnostic Tests for Coronavirus Disease-2019 during the Public Health Emergency” . De acordo com esse documento, testes sorológicos, destinados à detecção de anticorpos para SARS-CoV-2, que tenham sido validados e notificados ao FDA como EUA, devem conter em suas instruções de uso alertas de que:
• O teste não foi revisado pelo FDA • Os resultados negativos não podem excluir a infecção por SARS-CoV-2, particularmente naqueles que estiveram em contato com o vírus. Testes de biologia molecular devem ser considerados para descartar infecção nesses indivíduos.
• Os resultados do teste de anticorpos não devem ser usados como única base para diagnosticar ou excluir a infecção por SARS-CoV-2 ou para informar o status da infecção.
• Os resultados positivos podem ser causados por infecção passada ou presente por cepas de coronavírus que não sejam SARS-CoV-2, como coronavírus HKU1, NL63, OC43 ou 229E.
Além de orientações em instruções de uso, o fabricante deve fornecer, por meio de folhetos informativos direcionados a provedores de serviços de saúde e a pacientes, informações sobre riscos potenciais conhecidos e benefícios do uso de produtos autorizados para uso emergencial. Alertas e recomendações também foram divulgadas pelo FDA em carta direcionada a provedores de serviços de saúde, dentre elas, o FDA orienta que os serviços continuem a utilizar testes sorológicos, desde que cientes de suas limitações .
O CDC (Center for Disease Control and Prevention) possui diretrizes sobre quem deve ser testado, mas as decisões sobre a testagem ficam a critério dos departamentos de saúde estaduais e locais e / ou dos clínicos individuais . Outra fonte de consulta é o documento Toolkit Covid-19, uma coleção de recursos compilados e organizados pela AdvaMed para orientar os esforços de mensagens e comunicações. A publicação contempla ações realizadas pela Associação em resposta a crise, com foco na produção e distribuição de dispositivos médicos, entre eles os equipamentos de proteção pessoal, ventiladores e kits diagnósticos.
A relação de produtos que receberam EUAs para Covid-19 nos Estados Unidos pode ser consultada no Toollkit Covid-19 . Na Espanha, o “Guía para la utilización de Tests Rápidos de Anticuerpos Para Covid-19” , publicados pelo Ministério da Saúde, orienta sobre o uso de testes rápidos para detecção de COVID-19 dentro e fora de hospitais e em instituições penitenciárias. No Brasil, o “Boletim COE COVID-19 número 12” publicado pelo Ministério da Saúde , contempla informações sobre a vigilância epidemiológicas laboratorial, trazendo o histórico da implantação do diagnóstico de Covid-19 no país, desde suas fases iniciais até o momento atual.
O Ministério da Saúde preconiza o uso do teste sorológico para “toda a população que apresentar quadro de síndrome gripal e pertencer a uma das O papel dos testes de anticorpos no combate da pandemia do coronavírus seguintes categorias:
• Profissionais de saúde e segurança em atividade;
• Pessoa que resida no mesmo domicílio de um profissional de saúde ou segurança em atividade; • pessoas com idade igual ou superior a 60 anos;
• Portadores de condições de saúde crônicas, e
• População economicamente ativa.
O teste utilizado pelo Ministério da Saúde foi validado pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS) da Fundação Osvaldo Cruz e deve ser feito após o sétimo dia do início dos sintomas. Recomendações sobre a interpretação do resultado do teste são trazidas pelo documento, assim como a indicação de alternativas de validação dos testes disponíveis, que valerão como referência, em curso por entidades organizadas no “Programa de Validação de Kits de Diagnóstico para SARS-CoV-2” (SBPC/ML, SBAC, ABRAMED e CBDL).
Por fim, concluímos que, apesar das limitações para o uso de testes sorológicos (anticorpos) apontadas pela Organização Mundial de Saúde, esses testes poderão ser decisivos para a tomada de decisões clínicas e epidemiológicas no processo de enfrentamento da pandemia, desde que sua implementação seja bem estabelecida e de forma integrada entre os diferentes atores da Sociedade Civil e Governo. Assim, a atenção dada aos pontos essenciais será a chave do sucesso no combate ao coronavírus: acesso, qualidade, treinamento, testagem ampliada e captação dos dados para uma base epidemiológica.
Fonte: Labornews





