
por CenterLab | maio 4, 2022 | Informativos
No corpo humano todas as células apresentam um ciclo natural, elas são originadas, diferenciam-se, proliferam e morrem. Entretanto, algumas células saem desse ciclo, evadindo-se dos mecanismos de controle celular, geralmente em decorrência de mutações. Consequentemente, essas células dão origem a outras células com as mesmas imperfeições transformando-se em um tumor. Os tumores apresentam duas características principais que os diferenciam, sendo, ritmo de crescimento (divisão celular) e sua capacidade de infiltração para outros tecidos. A palavra câncer é oriunda do latim, no qual o significado é caranguejo, devido sua capacidade invasiva. O termo já sugere seu caráter maligno, devido seu crescimento exacerbado e capacidade de migração. Este processo facilita a entrada dessas células em outros tecidos do corpo, podendo inclusive utilizar a corrente sanguínea ou sistema linfático como mecanismo de transporte, gerando assim, um tumor secundário ou metástase.
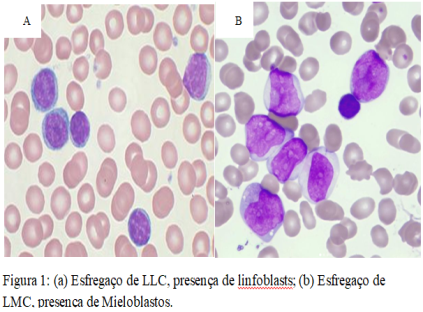
A leucemia, que vem do Grego LEUKOS, “branco”, mais HAIMA, “sangue”, são consideradas doenças malignas do sangue, ou seja, um tipo de câncer inicialmente originário na medula óssea, com consequências fisiológicas graves, podendo levar o indivíduo à morte. Nela ocorre a proliferação neoplásica generalizada ou acúmulo de células hematopoiéticas, com ou sem envolvimento do sangue periférico. Na maioria dos casos, as células leucêmicas (figura 1) extravasam para o sangue, onde podem ser vistas em grande número. Essas células também podem infiltrar o fígado, baço, linfonodos e outros tecidos. As leucemias podem ser agrupadas com base na velocidade em que a doença evolui e torna-se grave. Sob esse aspecto, a doença pode ser do tipo:
– Crônica (Caracterizada pelo aumento de células maduras, mas anormais). Nesse grupo, o câncer afeta majoritariamente as células que já passaram por certo processo de amadurecimento dentro da medula óssea e que já são mais desenvolvidas, de certa forma. No início da doença, as células leucêmicas ainda conseguem fazer algum trabalho dos glóbulos brancos normais. Geralmente descobrem se a doença durante exame de sangue de rotina. Lentamente, a leucemia crônica se agrava. À medida que o número de células leucêmicas aumenta, aparecem inchaço nos linfonodos (ínguas) ou infecções. Quando surgem, os sintomas são brandos, agravando-se gradualmente.
– Já a leucemia Aguda (caracterizam-se pela proliferação clonal acompanhada de bloqueio maturativo (anaplasia) variável. As células leucêmicas não podem fazer nenhum trabalho das células sanguíneas normais. O número de células leucêmicas cresce de maneira rápida e a doença agrava-se num curto intervalo de tempo.
As leucemias também podem ser agrupadas baseando-se nos tipos de glóbulos brancos que elas afetam: linfoides ou mieloides. As que afetam as células linfoides são chamadas de linfoide, linfocítica ou linfoblástica. A leucemia que afeta as células mieloides são chamadas Mieloide ou mieloblástica. Combinando as duas classificações, existem quatro tipos mais comuns de leucemia:
– Leucemia Linfoide Aguda (LLA) – é o câncer mais comum na infância causado por uma mutação nos linfócitos na medula óssea por algum erro no DNA. Esse dano gera um linfoblasto que não amadurece e, por isso, não se transforma em uma célula sanguínea funcional.
– Leucemia Mieloide Aguda (LMA) – é o tipo mais comum e mais agressivo da doença. A LMA progride rapidamente, e as células mieloides interferem na produção normal de glóbulos brancos e vermelhos e de plaquetas. Tem predominância em adultos mais velhos (acima de 60 anos de idade), com mais de 50% dos casos. É mais comum no sexo masculino do que no feminino, representa cerca de 15% a 20% das LA da infância e 80% das dos adultos e apresenta um prognóstico ruim, especialmente em pacientes idosos.
– Leucemia Linfoide crônica (LLC) – é caracterizada pelo acúmulo progressivo de linfócitos B malignos fenotipicamente maduros.Os locais primários da doença incluem sangue periférico, medula óssea, baço e linfonodos. Ela progride lentamente e costuma afetar idosos e é o tipo mais comum de leucemia no mundo ocidental.
– Leucemia Mieloide Crônica (LMC) – nesse tipo de leucemia, o corpo produz um grande número de células anormais da série Mieloide. Essas contagens vão aumentando de forma progressiva. É causada por uma mutação de cromossomos que ocorre espontaneamente. É comum ocorrer o aumento do baço associado, chamado de esplenomegalia.
Para o ano 2030, a Organização Mundial da Saúde (OMS) estimou 75 milhões de pessoas vivas com câncer, sendo 21 milhões de casos novos da doença e 13 milhões de mortes em todo mundo. Atualmente, a estimativa é de 14 milhões de casos novos e 8 milhões de mortes por câncer. O Instituto Nacional de Câncer (INCA) estima que, para cada ano do triênio 2020/2022, sejam diagnosticados no Brasil 5.920 casos novos de leucemia em homens e 4.890 em mulheres.
As causas da leucemia ainda não estão definidas, mas, suspeita-se da associação entre determinados fatores com o risco aumentado de desenvolver alguns tipos específicos da doença como: tabagismo, Síndrome de Down e outras doenças hereditárias, Síndrome mielodisplásica e outras doença sanguíneas, benzeno, radiação ionizante (raios X e gama), quimioterapia (algumas classes de medicamentos usados no tratamento do câncer e doenças auto-imunes), formaldeído, produção de borracha, história familiar, idade, exposição a agrotóxicos, solventes, diesel, poeiras, infecção por vírus de hepatite B e C.
Sintomas:
Os primeiros sinais geralmente aparecem quando a medula óssea deixa de produzir células sanguíneas normais. Tendo com principais sintomas palidez, cansaços, palpitações, gânglios aumentados, infecções persistentes ou recorrentes, hematomas, manchas avermelhadas pelo corpo, sangramentos incomuns, aumento do baço e do fígado, anemia, fraqueza, febre ou suores noturnos; perda de peso sem motivo aparente, dores nos ossos e nas articulações, dores de cabeça, náuseas, vômitos, visão dupla e desorientação.
Tratamento:
O tratamento vai desde quimioterápico ou medicamentos direcionados que eliminam especificamente as células cancerígenas até transplante de medula óssea.
Diagnóstico:
Diante da suspeita de um quadro de leucemia, um dos principais exames de sangue para confirmação é o hemograma. Em caso positivo, o hemograma estará alterado, mostrando na maioria das vezes um aumento do número de leucócitos (na minoria das vezes o número estará diminuído), associado ou não à diminuição das hemácias e plaquetas. Outras análises laboratoriais devem ser realizadas, como exames de bioquímica e da coagulação, e poderão estar alterados.
A confirmação diagnóstica é feita com o exame da medula óssea (mielograma). Entretanto o hemograma de uma pessoa com leucemia que apresenta alteração pode auxiliar no diagnóstico. É possível que elas apareçam em um curto intervalo de tempo e ajudem a identificar, precocemente, esse tipo de câncer. No caso das leucemias agudas, ou seja, a leucemia mieloide aguda (LMA) e leucemia linfoide aguda(LLA) há três principais elementos que devem ser analisados. A hemoglobina, as plaquetas e se há presença dos blastos. Caso o resultado do hemograma indique que o nível de hemoglobina está baixo (menor que 12g/dl), plaquetas baixas (menor que 100.000/mm³) e mais de 20% de blastos, há uma grande probabilidade de ser uma leucemia aguda. Já o hemograma de uma pessoa com leucemia crônica será diferente, dependendo do tipo de leucemia. Isso acontece porque cada subtipo apresenta um conjunto de alterações no exame de sangue. Na LMC, o nível de leucócitos é alto com aparecimento de leucócitos jovens. Sendo que há uma maior quantidade de elementos jovens em comparação com os mais velhos, chamado de desvio escalonado. Enquanto que na LLC, há um aumento de 40% dos linfócitos em comparação com o hemograma de uma pessoa saudável. Nesta situação o aumento dos linfócitos indica a presença de anomalia nestas células. A confirmação é feita pela imunofenotipagem e marcadores moleculares.
O progresso das tecnologias médicas recentes é notável. Em hematologia, muitos resultados da medição são processados automaticamente em sistemas de alto rendimento. A Centerlab, comprometida em oferecer o melhor em automação laboratorial, juntamente com a Nihon Kohden, empresa Japonesa com 40 anos de experiência na fabricação de analisadores hematológicos, apresenta sua linha equipamentos. Máquinas robustas fabricadas em aço inoxidável, de fácil operação pelo usuário, toda linha de equipamentos possui um sistema de filtros e limpeza automática para retenção e remoção de coágulos. Tudo isso além de tecnologias exclusivas da Nihon Khoden que trazem maior rapidez, segurança e qualidade no diagnóstico de doenças hematológicas.
Tecnologias Exclusivas Nihon Kohden:
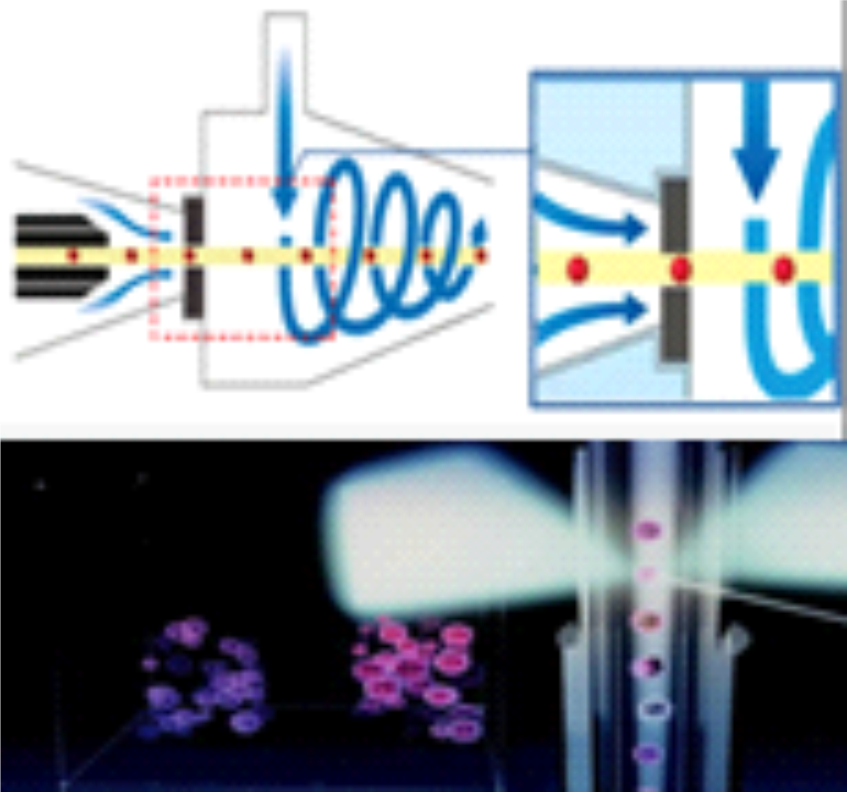
A tecnologia ótica ”DynaScatter Laser” (presentes no Celltac ES e Celltac G) analisa e diferencia as células WBC em seu estado “quase-nativo” com muita precisão. O inovador sistema de detecção de espalhamento de laser de 3 ângulos provê uma melhor diferenciação dos Leucócitos realizando uma medição precisa. A tecnologia chamada “DynaHelix Flow” (presente no Celltac G) alinha perfeitamente as células Leucócitos, Hemácias e Plaquetas para uma contagem de alta impedância com precisão usando um fluxo hidrodinâmico focado antes de passar pela abertura. Somado a isso, o fluxo contínuo após a contagem previne totalmente contra o risco de a mesma célula ser contada duas vezes (retorno).
Celltac α 6550
– Tecnologia Japonesa, velocidade de60 amostras/hora e volume de amostra: 30 microL;
– 19 Parâmetros: WBC, RBC, HGB, HCT, MCV, MCH, MCHC, RDW-CV, RDW-SD, PLT, PCT, MPV, PDW;
– Diferencial de Leucócitos em 3 partes (LY, LY%, MO, MO%, e GR, GR%)*;
– Verificação diária automática e livre de manutenção, gerenciamento da utilização dos reagentes, análise em tubo aberto e fechado,eliminando contato com sangue (biosegurança) e impressora térmica integrada;
– Remoção automática de coágulos, filtros de retenção de coágulos, compacto, durável, robusto todo em aço inox.
Celltac ES
– Tecnologia Japonesa, velocidade de60 amostras/hora e volume de amostra: 55μl;
– 25 Parâmetros: WBC, RBC, HGB, HCT, MCV, MCH, MCHC, RDW-CV, RDW-SD, PLT, PCT, MPV, PDW;
– Diferencial de Leucócitos 6 partes: LY, LY%, MO, MO%, NE, NE%, EO, EO%,BA, BA%, IG, IG%;
– Verificação diária automática e livre de manutenção, gerenciamento da utilização dos reagentes e análise em tubo aberto e fechado, eliminando contato com sangue (biosegurança);
– Contagem avançada de PLT e WBC para valores baixo automaticamente e impressora térmica integrada;
– Remoção automática de coágulos, filtros de retenção de coágulos e compacto, durável, robusto todo em aço inox.
Celltac G 9100
– Tecnologia Japonesa, velocidade de 90 amostras/hora e volume de amostra: 40 microL;
– 33 Parâmetros: WBC, RBC, HGB, HCT, MCV, MCH, MCHC, RDW-CV, RDW-SD, PLT, PCT, MPV, PDW, P-LCR, PLCC, Índice Mentzer e RDW-I;
– Diferencial de Leucócitos 7 partes: LY, LY%, MO, MO%, NE, NE%, EO, EO%,BA, BA%, Band, Band%, IG, IG%, Seg% e Seg;
– Verificação automática e livre de manutenções diárias, extremamente fácil operação, valores de controles adicionados automaticamente por cód. de barras, Carregamento continuo de amostras com capacidade para 7 racks de 10 tubos e jomogeneização e análise automática das amostras (tubo fechado);
– Gerenciamento e rastreabilidade dos reagentes;
– Remoção automática de coágulos, filtros de retenção de coágulos, compacto, durável, robusto todo em aço inox;
– Os recém adicionados RDWI e Índice Mentzer adicionam valiosas informações clínicas para que se possa diferenciar beta-talassemia de uma possível anemia ferropriva nos casos de anemia microcítica.

Importante: Esse boletim tem o caráter informativo e não deve ser utilizado para interpretação de resultados e manejo clínico.
Referencias:
– http://www.oncoguia.org.br/conteudo/sinais-e-sintomas-da-leucemia-mieloide-aguda-lma/1598/332/
– https://www.rededorsaoluiz.com.br/clinica/cehon/sobre-o-cancer/neoplasias-hemat/leucemia-cronica
– https://www.msdmanuals.com/pt-br/profissional/hematologia-e-oncologia/leucemia/leucemia-linfoc%C3%ADtica-cr%C3%B4nica-llc
– https://www.scielosp.org/article/csc/2017.v22n10/3321-3332/
– https://portal.unisepe.com.br/unifia/wp-content/uploads/sites/10001/2019/02/022_LEUCEMIA-MIELOIDE-AGUDA-E-CR%C3%94NICA-DIAGN%C3%93STICOS-E-POSS%C3%8DVEIS-TRATAMENTOS.pdf
– https://www.scielo.br/j/jbpml/a/C6NQ7KQYbZNsdpp7TGW7vpk/?format=pdf&lang=pt
– https://www.inca.gov.br/tipos-de-cancer/leucemia
– https://revista.abrale.org.br/hemograma-e-diagnostico-de-leucemia/
– https://bvsms.saude.gov.br/bvs/publicacoes/inca/Avaliacao_epidemiologica_das_leucemias_linfoblasticas_em._pa.pdf
– https://www.einstein.br/especialidades/oncologia/tipos-cancer/leucemia

por CenterLab | nov 10, 2020 | Informativos
Sai o Outubro Rosa, entra o Novembro Azul. O Brasil tem se mostrado um país preocupado com a saúde preventiva e essas campanhas são fundamentais para trazer uma maior conscientização sobre temas importantes para todos, incluindo a população masculina.
O Novembro Azul foi criado em 2003, na Austrália, com o título Movember, e iniciou no Brasil a partir de 2014, quando o Instituto Lado a Lado pela Vida realizou 2.200 ações em todo o País, por meio da iluminação de diversos pontos turísticos, como o Monumento às Bandeiras, em São Paulo, com o objetivo de alertar para a necessidade de prevenção ao câncer de próstata e diagnóstico precoce de outras doenças originárias desta glândula, como a prostatite e Hiperplasia Prostática Benigna (HPB).
De lá para cá, o movimento ganhou corpo e ações diversas têm sido realizadas, alertando para a gravidade da situação, principalmente em tempos de pandemia. É o que comprova levantamento do Instituto Nacional do Câncer (Inca). Segundo o órgão, somente para 2020 são esperados 65.840 novos casos de câncer de próstata e, muitos deles podem não ser diagnosticados a tempo por conta do isolamento social.
Prova disso é que houve uma queda de 70% das cirurgias oncológicas e diminuição de 50% a 90% das biópsias enviadas para análise. Diante desse quadro, estima-se que entre 50 mil a 90 mil brasileiros deixaram de receber diagnóstico de câncer nesse período.
Este quadro de falha pode agravar ainda mais os números da doença. Diariamente, 42 homens morrem em decorrência do câncer de próstata e, aproximadamente, 3 milhões vivem com a doença, sendo a segunda maior causa de morte por câncer em homens no Brasil.
Autocuidado
Diante deste cenário, torna-se ainda mais importante o autocuidado para prevenir a doença e, consequentemente, salvar vidas. Algumas dicas da Sociedade Brasileira de Urologia (SBU), neste sentido, são:
– Homens, a partir de 50 anos, mesmo sem apresentar sintomas, devem procurar um urologista, com o objetivo de diagnosticar precocemente o câncer de próstata, por meio do exame de toque retal ou de sangue PSA, que permitem ao médico avaliar alterações da glândula, como endurecimento e presença de nódulos suspeitos.
– Homens que integram o grupo de risco (raça negra ou com parentes de primeiro grau com câncer de próstata) devem fazer o exame, a partir dos 45 anos.
– Outros exames podem ser solicitados, caso haja suspeita de câncer de próstata, como as biópsias, que retiram fragmentos da próstata para análise.
Sintomas
Como destacamos, o Novembro Azul propõe, a partir da prevenção, o diagnóstico precoce do câncer de próstata, que é assintomático em sua fase inicial, quando em 90% dos casos ele pode ser curado, desde que diagnosticado precocemente. Em fases mais avançadas, aparecem os seguintes sintomas:
– Vontade de urinar com frequência.
– Presença de sangue na urina ou no sêmen.
– Dor óssea.
Fatores de risco
Tão importante quanto a prevenção, é entender os fatores de risco que podem levar à incidência do câncer de próstata, com destaque para:
– Histórico familiar de câncer de próstata em pai, irmão ou tio.
– Homens da raça negra estão mais predispostos a ter a doença.
– Obesidade
Tratamento
Agora, se a realização dos exames indicar a ocorrência do câncer de próstata, alguns tipos de tratamento são recomendados:
– Para doença localizada (que só atingiu a próstata, sem se espalhar para outros órgãos), é recomendada a cirurgia, radioterapia e observação vigilante (em algumas situações especiais).
– Para doença localmente avançada, indica-se a radioterapia ou cirurgia em combinação com tratamento hormonal.
– Para doença metastática (quando o tumor já se espalhou para outras partes do corpo), o tratamento mais apropriado é a terapia hormonal.
Tem alguma dúvida ou sugestão sobre o assunto? Comente e contribua para ampliarmos os conteúdos dos nossos posts! Consulte também nossas publicações e assine a nossa newsletter para acompanhar as novidades.
Fonte: Labtest
por CenterLab | abr 17, 2020 | Informativos
Parte dos tumores deste tipo de câncer inicia-se a partir de pólipos, lesões benignas que podem crescer na parede interna do intestino grosso.
O câncer colorretal diz respeito ao crescimento desordenado de células na região do intestino grosso (o cólon) e no reto. Como a maioria dos cânceres, se tratado precocemente, é curável, pois não há a propensão de não ter se espalhado para outros órgãos.
Portanto, recomenda-se atenção a sintomas como mudança no hábito intestinal, desconforto abdominal com gases ou cólicas, sangramento nas fezes, entre outros fatores.
Idade acima de 50 anos, história familiar de câncer colorretal, história pessoal da doença (já ter tido câncer de ovário, útero ou mama), além de obesidade e inatividade física são algumas condições de risco à doença.
A tecnologia avançou muito nesse sentido, provendo exames não invasivos e com índices de diagnósticos muito mais precisos. No artigo que segue, é possível compreender mais sobre esta evolução.
Métodos de triagem não invasivos ajudam no diagnóstico precoce
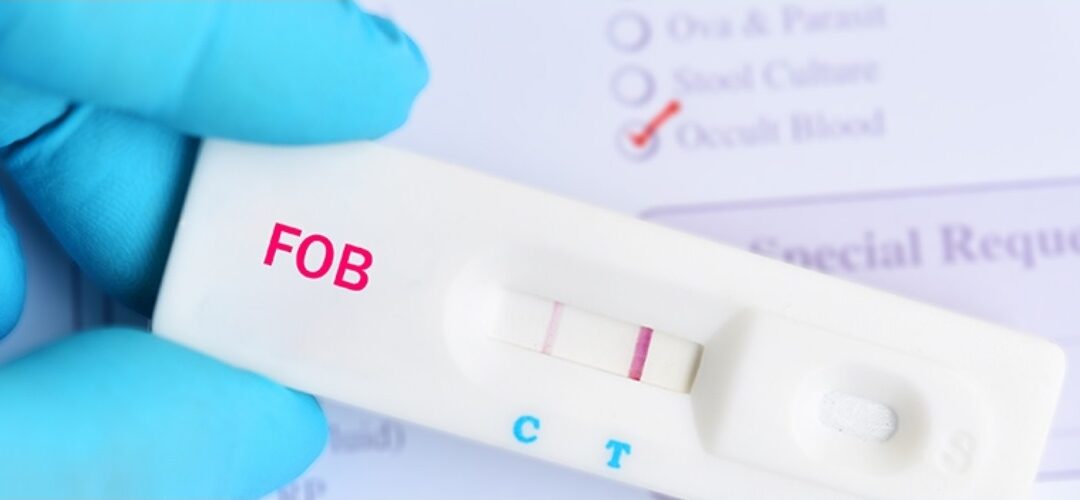
A determinação de sangue oculto nas fezes é um método eficaz de triagem, não invasivo ao paciente e de menor custo. A determinação da hemoglobina em amostras de fezes é empregada nestes exames. A hemoglobina é uma metaloproteína de ferro e está presente nas hemácias que são componentes do sangue, que circulam dentro dos vasos sanguíneos com a função de transportar oxigênio entre os pulmões e os tecidos.
As lesões no cólon e reto podem acarretar o extravasamento do sangue para as fezes e aparecimento da hemoglobina nesse tipo de amostra. Geralmente, a quantidade de sangue será pequena, na escala de ng/mL ou µg/g, não podendo ser detectada a olho nu. Por esta razão, diz-se “sangue oculto”. Quando o sangue puder ser detectado visualmente nas fezes, recomenda-se ir imediatamente ao médico.
Evolução dos métodos de triagem e diagnóstico
A Organização Mundial da Saúde (OMS) preconiza que pessoas acima de 50 anos devem realizar o exame de sangue oculto nas fezes. Para resultados reagentes (positivos), o paciente deve ser encaminhado para colonoscopia ou retossigmoidoscopia que são os exames confirmatórios, entretanto, complexos, invasivos e de alto custo.
É notável a evolução dos produtos para determinação de sangue oculto nas fezes. Durante muito tempo, os utilizados para este fim empregavam o método guaiáco, que tem a sigla gFOBT. Este método se baseia na oxidação do ácido guaiacônico, catalisado pela ação da peroxidase. Para este teste, é necessário que o paciente realize dieta restritiva de alguns alimentos durante três dias, antes da realização da coleta de amostra.
Mais recentemente, produtos com método imunológico, que tem a sigla iFOBT, têm sido empregados para a determinação de sangue oculto nas fezes. Estes produtos utilizam anticorpos específicos anti-hemoglobina humana, o que faz com que possam ser utilizados sem a necessidade de dieta restritiva. A utilização destes anticorpos específicos garante a ausência de reação cruzada com outras hemoglobinas de origem animal, melhorando a capacidade do teste de reconhecer especificamente a hemoglobina humana.
Entre os métodos imunológicos para pesquisa de sangue oculto nas fezes estão os testes rápidos, que empregam metodologia imunocromatográfica e apresentam resultado em até 30 minutos.
A Labtest disponibiliza em seu portfólio o teste rápido Sangue Oculto iFOBT, que emprega anticorpos monoclonais específicos anti-hemoglobina humana, o que garante a alta especificidade. Esse reagente tem sensibilidade metodológica de 0,04 µg/mL ou 40 ng/mL detectando a presença de hemoglobina nas fezes a partir desta concentração.
Além da avaliação deste produto com amostras de fezes, estudos evidenciaram que a verificação da recuperação do valor especificado de sensibilidade metodológica em amostras artificiais poderia sofrer interferência da composição da matriz do tampão, assim como a da origem da fonte de hemoglobina utilizada.
O produto Sangue Oculto iFOBT é composto por placa de reação (cassete) e tampão, e apresenta resultados após 5 minutos. Ele está disponível em kit para realização de 20 testes.
Fonte: Labtest
por CenterLab | jan 9, 2020 | Informativos
Estudo identifica uma assinatura de 16 espécies microbianas capaz de predizer o câncer colorretal; resultados podem contribuir para criar exame preditivo válido para populações com diferentes culturas alimentares.
O microbioma, conjunto de microrganismos presentes no intestino, pode ser usado para prever a ocorrência do câncer colorretal – o segundo tipo de tumor mais frequente em mulheres e o terceiro entre os homens.
Uma pesquisa feita por uma equipe internacional, com participação brasileira, identificou padrões no microbioma intestinal – que independem da cultura alimentar das populações estudadas – e detectou associação entre alterações nesse padrão e a ocorrência de câncer colorretal. A descoberta abre caminho para o desenvolvimento de exames não invasivos capazes de prever a ocorrência da doença.
O estudo, publicado nesta segunda-feira (01/04) na revista Nature Medicine, tem como primeiro autor Andrew Maltez Thomas, doutor em Bioinformática pela Universidade de São Paulo (USP), e teve apoio da FAPESP por meio de uma Bolsa de Pesquisa no Exterior, realizada na Universidade de Trento, na Itália.
Os pesquisadores combinaram análise de metagenômica, bioinformática e aprendizagem de máquina (com uso de inteligência artificial) para correlacionar a ocorrência do câncer colorretal com dados do microbioma de 969 pessoas da Alemanha, França, Itália, China, Japão, Canadá e Estados Unidos. Trata-se de um dos maiores e mais variados estudos sobre o tema.
Os resultados não só estabelecem conjuntos de microrganismos associados ao câncer colorretal em todas as populações estudadas, mas também indicam assinaturas no metabolismo microbiano (padrão de metabólitos produzidos pelos microrganismos) que também têm poder de prever a ocorrência da doença.
A análise rendeu ainda outros dois achados importantes. Um deles se refere a maior prevalência de bactérias comumente encontradas na boca e nas vias aéreas no intestino de pacientes com câncer colorretal. A outra descoberta indica a associação entre a doença e a presença de uma enzima microbiana que degrada a colina, um nutriente que faz parte do complexo B de vitaminas.
No estudo, pacientes com câncer colorretal apresentaram maior presença de bactérias da espécie Fusobacterium nucleatum em comparação com indivíduos saudáveis. Essa bactéria normalmente habita regiões da boca. Era esperado, até então, que o ambiente ácido do estômago fosse fatal para tais microrganismos.
“Há um aporte maior de espécies orais indo para o intestino em pacientes com câncer colorretal. Talvez essa migração cause inflamações no intestino, originando o tumor. No entanto, não sabemos ainda o real motivo de elas se transportarem para o intestino. Sabemos apenas que há uma associação entre a sua presença no intestino e o câncer colorretal. É algo que ainda precisa ser melhor entendido”, disse Thomas.
A detecção de maior abundância do gene da enzima microbiana colina-trimetil-liase (cutC) nas amostras fecais dos pacientes com câncer mostra uma possível ligação entre a microbiota e os resultados de estudos anteriores sobre a relação da doença com uma alimentação rica em gordura.
“Essa enzima degrada a colina, metabólito presente em dietas com altas concentrações de carne vermelha e de outros alimentos gordurosos. Após degradar a colina ela libera acetaldeído, uma conhecida substância carcinogênica”, disse Thomas.
No estudo, os pesquisadores analisaram dados sobre a composição e a abundância de todas as bactérias encontradas nas 969 amostras fecais. Para obter um método de análise mais simples, que possa ser usado amplamente em clínicas e hospitais, os pesquisadores conseguiram selecionar as bactérias com maior peso na análise.
“Com 16 espécies, obtivemos resultados comparáveis às análises feitas com todas as espécies. É um passo, portanto, na direção de se ter uma ferramenta diagnóstica simples, sem precisar sequenciar toda a microbiota e sem deixar de ter a precisão necessária”, disse Thomas.
Causa ou consequência
A relação entre microbiota do intestino e saúde humana é uma área de pesquisa que tem crescido, sobretudo nos últimos 10 anos. O novo estudo, no entanto, segue um conceito inovador de utilização de bactérias como marcadores de desenvolvimento de uma doença.
“O mais comum é buscar marcadores associados diretamente a células tumorais. Em nosso trabalho, o conceito é outro. A análise é feita a partir de alterações de um conjunto relativamente pequeno de bactérias dentro de um espectro de centenas de bactérias que estão no intestino e que podem indicar uma doença”, disse Emmanuel Dias-Neto, do Centro Internacional de Pesquisas (Cipe) no A.C.Camargo Cancer Center, também autor do artigo.
Com a análise de sequências de DNA obtidas da microbiota é possível descobrir quais bactérias estão presentes na microbiota de cada amostra, além de identificar a quantidade de cada uma das bactérias e variantes do genoma desses microrganismos que podem estar relacionadas com diferentes desfechos – como, por exemplo, a ocorrência ou risco aumentado de câncer colorretal.
No entanto, é preciso destacar que o estudo não revelou que uma microbiota alterada causa o câncer colorretal.
“Foi detectada uma associação, o que não implica necessariamente uma relação causal. A pergunta que fica é: são essas determinadas bactérias que estão provocando o câncer ou é o câncer que cria um ambiente diferente no duto colorretal e, assim, faz com que certas bactérias sejam favorecidas em relação a outras? Ainda não temos essa resposta, que será fundamental para que os resultados deste artigo possam futuramente ajudar no desenvolvimento de terapias para o tratamento do câncer colorretal”, disse João Carlos Setubal, coordenador do Programa Interunidades de Pós-Graduação em Bioinformática da USP e outro autor do artigo. Setubal e Dias-Neto orientaram o doutorado de Thomas.
Análise computacional
Segundo os pesquisadores, esta é talvez a maior análise sobre câncer colorretal com dados de amostras fecais e com populações tão diversas. A equipe de pesquisadores analisou os dados de cinco estudos públicos com dados de outros dois estudos realizados pelos pesquisadores na Universidade de Trento.
Com as informações obtidas nos sete estudos, foi possível identificar enzimas, bactérias e como a microbiota é capaz de predizer a presença do câncer colorretal. Os dados de outros dois estudos, com mais 200 amostras, foram usados para validar os achados.
“O sequenciamento de DNA das amostras – cuja análise exige distinguir entre DNA da microbiota e DNA humano – foi uma forma de identificar e quantificar as espécies de microrganismos e seus genes presentes nessas amostras. Extraímos o DNA das amostras fecais e o sequenciamos. Depois, com métodos computacionais, analisamos os dados. Conseguimos identificar e quantificar quais espécies estavam presentes e qual era a abundância dos genes”, disse Thomas.
Por serem dados oriundos de estudos diferentes, os pesquisadores usaram métodos estatísticos sofisticados para analisá-los em conjunto.
“Empregamos análises estatísticas que são usadas para fazer meta-análise, e também foram utilizadas técnicas de aprendizado de máquina para compreendermos o quão preditivos são os resultados”, disse Thomas.
Além de validar os dados, o grupo de Nicola Segata, da Universidade de Trento e líder do projeto, teve seus resultados reforçados por outro estudo realizado no European Molecular Biology Laboratory (EMBL), com sede na Alemanha. Os cientistas do EMBL também estudaram a relação entre microbioma e câncer e tiveram artigo publicado na mesma edição da Nature Medicine.
“Ao longo da preparação dos artigos, trocamos dados e informações com o outro grupo, numa parceria que se mostrou muito importante para reforçar nossos achados. Apesar de usarmos técnicas de aprendizagem de máquina e métodos estatísticos diferentes chegamos ao mesmo resultado: que o microbioma intestinal é capaz de predizer a presença de câncer colorretal em diferentes populações e estudos”, disse Thomas. Com informações da Fapesp.
Fonte: Labnetwork
Publicado em: 02/04/2019

por CenterLab | jul 18, 2019 | Informativos
Imagem site da Kasvi
A biópsia é um procedimento muito comum na prática médica, no entanto, ainda existe uma ampla parcela de pacientes que nutre certo temor a respeito do exame por ser uma prática pouco entendida por grande parte da população. Ao contrário do que a maioria acredita, a solicitação de uma biópsia nem sempre significa suspeita de câncer.
A biópsia é indicada tanto em enfermidades simples, como as verrugas, como nas mais graves, como o câncer. Mas também pode ajudar no diagnóstico de doenças infecciosas, determinando o agente causal. Em doenças autoimunes, ajuda a confirmar ou informar as alterações esperadas em órgãos ou tecidos. Uma biópsia também pode ajudar a avaliar a gravidade da lesão e a evolução do tratamento. Em lesões de malignidade suspeita ou confirmada, ajuda a estabelecer o grau histológico de neoplasia e a determinar a natureza, taxa de crescimento e agressividade do tumor, ajudando a elaborar o plano do tratamento e a prever o prognóstico da doença.
COMO É FEITA A BIÓPSIA?
Em geral as biópsias são realizadas sem necessidade de internação. Uma biópsia bem-feita começa com uma adequada coleta do material. O profissional deve escolher a melhor área da lesão a ser coletada, a extensão correta de coleta e o material a ser colhido. O material colhido deverá ser conservado em solução de formol e posteriormente enviado a um laboratório de patologia, para avaliação e emissão de um laudo histopatológico.
PREPARO DA AMOSTRA:
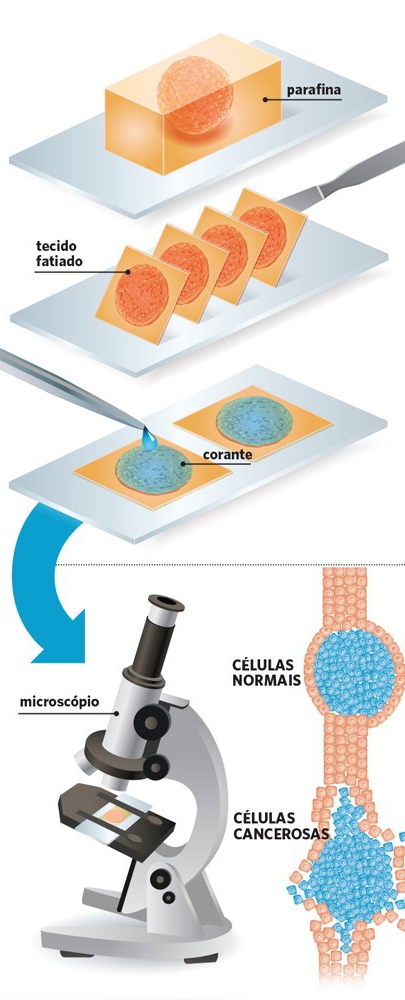
Imagem site da Kasvi
1 – Começa-se por colocar o tecido num fixador que evitará qualquer deterioração. Depois, a amostra será desidratada e embebida em parafina para que se preservem as células e a estrutura.
2 – Quando o tecido já está incorporado, corta-se o bloco de parafina com o tecido embebido em fatias mais finas do que uma fração de um cabelo humano. Estas fatias finas são colocadas numa lâmina de vidro, retira-se a parafina do tecido e, depois, utilizam-se corantes diferentes para identificar as estruturas celulares distintas e suas características especiais.
3 – No diagnóstico da patologia o processo de coloração inicial designa-se por hematoxilina & eosina (H&E) – e permite corar diferentes células e estruturas tornando-as visíveis ao microscópio. O patologista pode, assim, detectar o crescimento irregular das células e determinar o próximo passo do tratamento.
Na maior parte dos casos é possível obter um diagnóstico somente com a coloração H&E, mas há casos em que são necessárias colorações especiais. Estas colorações especiais podem detectar, por exemplo, certas quantidades de proteínas que indicam a probabilidade de um doente responder a determinados tratamentos.
Os prazos necessários para que se possa produzir esses laudos variam de acordo com o tipo de lesão, do material a ser analisado e o procedimento técnico adotado. O prazo médio oscila entre sete e quatorze dias, podendo chegar a um mês em casos de exames mais sofisticados.
TIPOS DE BIÓPSIA
O tipo de biópsia a ser realizado depende do tipo de lesão, do órgão a ser estudado, da hipótese diagnóstica e de condições pessoais do paciente:
– Biópsias externas: Quando feitas em lesões superficiais, geralmente salientes na pele ou mucosas.
– Biópsias interna: Feitas por incisão ou punção às cegas ou guiadas por ultrassonografia ou por endoscopia.
– Biópsias extemporânea ou perioperatórias: Feitas durante uma cirurgia.
– Biópsias incisionais: Quando é retirada apenas uma parte da lesão.
– Biópsias excisionais: Quando é retirada a lesão inteira.
– Biópsias por aspiração: Quando o material a ser examinado é aspirado por uma seringa ou instrumento semelhante. Este tipo de biópsia se divide em dois tipos:
Punção e aspiração com agulha fina (PAAF): Esta punção retira células e líquidos de tumores, com frequência de glândulas como a tireoide ou a mama. Este exame é rápido e não é muito doloroso, podendo ser realizado sem anestesia. A desvantagem deste tipo de biópsia é que por ser uma agulha fina, pouco material pode ser recolhido e a precisão é baixa.
Punção e aspiração com agulha grossa (PAAG): Diferente da anterior, este tipo de punção utiliza uma agulha mais grossa, capaz de remover pedaços de mais de 1 cm. É usada anestesia local para a inserção da agulha e de três a seis amostras glandulares são retiradas para precisão do diagnóstico.
– Biópsia Líquida: O recente interesse por ácidos nucleicos do sangue abriu novas áreas de investigação e possibilidades para o diagnóstico molecular. Em oncologia, alterações genéticas derivadas de tumor, alterações epigenéticas e ácidos nucleicos virais são encontrados no plasma/soro de pacientes com câncer. Esses achados têm importantes implicações para a detecção, o monitoramento e o prognóstico de muitos tipos de cânceres. A caracterização molecular do tumor de um paciente para orientar as decisões de tratamento é cada vez mais aplicada em cuidados clínicos e pode ter um impacto significativo no resultado da doença.
A medicina personalizada para pacientes com câncer visa adequar as melhores opções de tratamento para o indivíduo no momento do diagnóstico e durante o tratamento. Uma dessas abordagens é feita por meio da biopsia líquida, na qual a composição genética do tumor pode ser avaliada pela amostra de biofluidos. As biopsias líquidas têm o potencial de ajudar os oncologistas a rastrearem a doença, estratificar os pacientes para adoção do melhor tratamento e monitorar a resposta à terapêutica e os mecanismos de resistência no tumor. Sua natureza não invasiva permite repetir a amostragem para monitorar a quantificação ou a ausência do DNA tumoral ao longo do tempo, sem a necessidade de uma biopsia tecidual.
Fonte: Site Kasvi










