Cuidados pré analíticos em hemostasia
Para entregar um resultado laboratorial preciso e confiável, um laboratório clínico deve implementar um sistema adequado de gerenciamento de qualidade. Cerca de 60% dos erros laboratoriais ocorrem na fase pré-analítica, e em nenhuma outra área do laboratório o pré-analítico é tão crítico quanto na hemostasia. Nesse informativo iremos discorrer sobre os erros e suas implicações nos variados processos pré-analíticos (Coleta, Manuseio, Transporte e Preparo).
Condições pré-analíticas que afetam os testes de coagulação:
Preparo do Paciente:
– Exercício físico: A alteração da coagulação e da fibrinólise depende da intensidade do exercício;
A atividade moderada pode aumentar a agregação plaquetária, aumento de níveis de serotonina plasmática e beta tireoglobulina. Aumento de até 2,5x de Fator VIII, Von Willebrand e Ristocetina.
– Stress emocional: Aumenta os níveis de Fator VIII, Von Willebrand, Ristocetina, Fibrinogênio e Tempo de Protrombina.
– Níveis hormonais: A gestação é um estado pró-trombótico, aumenta os níveis de Fator VIII, Von Willebrand e a Proteína S total e livre é diminuída de 2 a 3 vezes. No ciclo menstrual o fibrinogênio diminui no período menstrual e aumenta na fase lútea. Menopausa aumenta os níveis de vários fatores, principalmente fator VIII e fibrinogênio.
– Variação circadiana: Na manhã tem maiores níveis de agregação plaquetária, atividade de fator VIII, níveis de Proteína C e Proteína S. A tarde a antitrombina atinge o valor máximo.
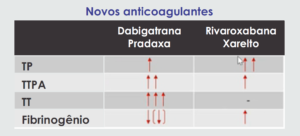
– Medicamentos: Além da conhecida warfarina que altera principalmente o TP, hoje com avanço dos medicamentos anticoagulantes temos a nova geração abaixo.
Cuidados com a coleta:
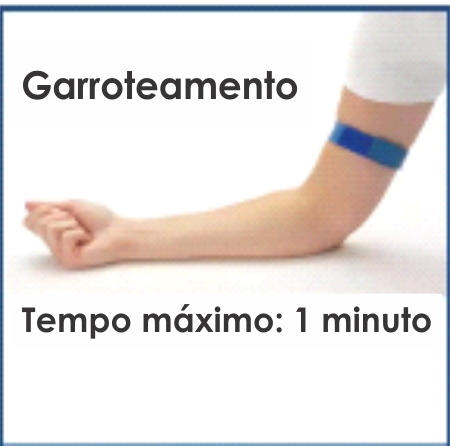
– Garroteamento: Fonte considerável de variabilidade e alterações nas proteínas plasmáticas da coagulação e agregação plaquetária. Garroteamento de 1-3 minutos leva a diferenças significativas em todos os testes de rotina da coagulação, principalmente tempo de protrombina, fibrinogênio e Dimero D.
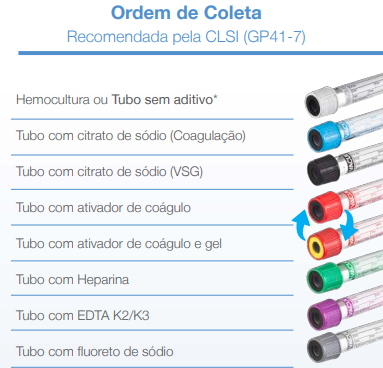
 – Sequência dos tubos: As amostras devem ser colhidas de maneira a preservar a integridade das proteínas, enzimas e cofatores. A punção traumática acarreta a liberação de tromboplastina tecidual e ativação plaquetária, encurtando o TP e TTPA, consumo do fibrinogênio e outros fatores. Deve se observar a sequência dos tubos de coleta, volume de preenchimento dos tubos de citrato de sódio 3,2 % (proporção 9/1).
– Sequência dos tubos: As amostras devem ser colhidas de maneira a preservar a integridade das proteínas, enzimas e cofatores. A punção traumática acarreta a liberação de tromboplastina tecidual e ativação plaquetária, encurtando o TP e TTPA, consumo do fibrinogênio e outros fatores. Deve se observar a sequência dos tubos de coleta, volume de preenchimento dos tubos de citrato de sódio 3,2 % (proporção 9/1).
– Homogeneização: Inverter suavemente os tubos entre 4 e 8 vezes, a homogeneização excessiva pode causar hemólise e agregação plaquetária.
Preparo da amostra
ꞏ Transporte: As amostras devem ser enviadas o mais rápido possível para o laboratório e podem ser transportadas nas seguintes condições:
1.Sangue total (citrato de sódio);
2. Centrifugadas, porém mantidas em tubo primário;
3.Centrifugadas e aliquotadas.
As amostras em tubo primário sem centrifugação ou centrifugadas devem ser mantidas tampadas e em temperatura ambiente. Amostras em sangue total não devem ser refrigeradas, armazenadas em gelo ou banho de gelo. O transporte não deve ultrapassar 1 hora, deve ser feito em temperatura ambiente com os tubos na posição vertical. Para transporte externo, congelar logo após a separação do plasma e transportar em container com gelo seco.
– Centrifugação: Padronizar a velocidade de centrifugação em 1500 G, centrifugar os tubos fechados e em temperatura ambiente por 15 minutos.
– Amostras congeladas: Descongelar a 37° por 5 a 10 minutos, não descongelar em temperatura ambiente nem em geladeira. Homogeneizar adequadamente após descongelamento.
– Manipulação: Utilizar somente material plástico.
– Armazenamento: Após a centrifugação o plasma pode permanecer no tubo primário ou pode ser aliquotado para tubo secundário. No preparo das alíquotas, tomar cuidado para não aspirar a camada onde se encontram os leucócitos e plaquetas. Durante o armazenamento os tubos devem permanecer tampados.
Amostra Ideal
– Coleta atraumática e com garroteamento mínimo;
– Volume de preenchimento adequado;
– Homogeneização adequada com o anticoagulante;
– Transporte de amostra em temperatura ambiente;
– Centrifugação em até 1hora após a coleta.
A Centerlab possui linha completa de Coagulação com equipamentos e reagentes de primeira linha. Além de contar com a melhor rede de assessores científicos capacitados a orientar o analista sobre as boas práticas de execução dos testes em hemostasia.
Elite Pro
Metodologia: Ótico Nefelométrico;
Velocidade: 175 TP/hora; 110 TTPA/hora;
Capacidade: 40 amostras, 22 reagentes (14 ambiente, 8 refrigerados).
ACL TOP350
Metodologia: Ótico LED
Velocidade 110 TP/hora; 110 TTPA/hora
Capacidade: 40 amostras (4 racks), 26 Reagentes refrigerados
HIL: Detecção de Hemólise, Icterícia e Lipemia
Detecção de coágulos e amostra insuficiente.
 Referências:
Referências:
– M.Blomback. J Tromb Haemost 2007; 5: 855-8
– CLSI: www.clsi.org – Clinical and Laboratory Stantards Institute
– Testes de Hemostasia: Documento H21 – A5 – 2008, Coleta Transporte, processamento e Armazenamento de Amostra
– 2005: Anvisa – Resolução da Diretoria Colegiada RDC302